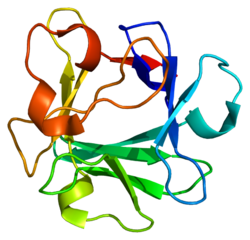
FGF2
| FGF2 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||
| |||||||||||||||||
| Ідентифікатори | |||||||||||||||||
| Символи | FGF2, BFGF, FGF-2, FGFB, HBGF-2, fibroblast growth factor 2 | ||||||||||||||||
| Зовнішні ІД | OMIM: 134920 MGI: 95516 HomoloGene: 1521 GeneCards: FGF2 | ||||||||||||||||
| |||||||||||||||||
| Шаблон експресії | |||||||||||||||||
  | |||||||||||||||||
| Більше даних | |||||||||||||||||
| Ортологи | |||||||||||||||||
| Види | Людина | Миша | |||||||||||||||
| Entrez |
|
| |||||||||||||||
| Ensembl |
|
| |||||||||||||||
| UniProt |
|
| |||||||||||||||
| RefSeq (мРНК) |
|
| |||||||||||||||
| RefSeq (білок) |
|
| |||||||||||||||
| Локус (UCSC) | Хр. 4: 122.83 – 122.9 Mb | Хр. 3: 37.4 – 37.46 Mb | |||||||||||||||
| PubMed search | [1] | [2] | |||||||||||||||
| Вікідані | |||||||||||||||||
| |||||||||||||||||
FGF2 (англ. Fibroblast growth factor 2) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 4-ї хромосоми.[3] Довжина поліпептидного ланцюга білка становить 288 амінокислот, а молекулярна маса — 30 770[4].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MVGVGGGDVE | DVTPRPGGCQ | ISGRGARGCN | GIPGAAAWEA | ALPRRRPRRH | ||||
| PSVNPRSRAA | GSPRTRGRRT | EERPSGSRLG | DRGRGRALPG | GRLGGRGRGR | ||||
| APERVGGRGR | GRGTAAPRAA | PAARGSRPGP | AGTMAAGSIT | TLPALPEDGG | ||||
| SGAFPPGHFK | DPKRLYCKNG | GFFLRIHPDG | RVDGVREKSD | PHIKLQLQAE | ||||
| ERGVVSIKGV | CANRYLAMKE | DGRLLASKCV | TDECFFFERL | ESNNYNTYRS | ||||
| RKYTSWYVAL | KRTGQYKLGS | KTGPGQKAIL | FLPMSAKS |
Кодований геном білок за функціями належить до факторів росту, мітогенів, білків розвитку, фосфопротеїнів. Задіяний у таких біологічних процесах як ангіогенез, диференціація. Білок має сайт для зв'язування з молекулою гепарину. Локалізований у ядрі. Також секретований назовні.
Рекомбінантний людський FGF2 (трафермін) є лікарським засобом, що використовується для лікування виразок та опіків.
Література
- Kurokawa T., Sasada R., Iwane M., Igarashi K. (1987). Cloning and expression of cDNA encoding human basic fibroblast growth factor. FEBS Lett. 213: 189—194. PMID 2435575 DOI:10.1016/0014-5793(87)81489-8
- Gimenez-Gallego G., Conn G., Hatcher V.B., Thomas K.A. (1986). Human brain-derived acidic and basic fibroblast growth factors: amino terminal sequences and specific mitogenic activities. Biochem. Biophys. Res. Commun. 135: 541—548. PMID 3964259 DOI:10.1016/0006-291X(86)90028-8
- Gautschi P., Frater-Schroeder M., Boehlen P. (1986). Partial molecular characterization of endothelial cell mitogens from human brain: acidic and basic fibroblast growth factors. FEBS Lett. 204: 203—207. PMID 3732516 DOI:10.1016/0014-5793(86)80812-2
- Goretzki L., Burg M.A., Grako K.A., Stallcup W.B. (1999). High-affinity binding of basic fibroblast growth factor and platelet-derived growth factor-AA to the core protein of the NG2 proteoglycan. J. Biol. Chem. 274: 16831—16837. PMID 10358027 DOI:10.1074/jbc.274.24.16831
- Skjerpen C.S., Wesche J., Olsnes S. (2002). Identification of ribosome-binding protein p34 as an intracellular protein that binds acidic fibroblast growth factor. J. Biol. Chem. 277: 23864—23871. PMID 11964394 DOI:10.1074/jbc.M112193200
- Eswarakumar V.P., Lax I., Schlessinger J. (2005). Cellular signaling by fibroblast growth factor receptors. Cytokine Growth Factor Rev. 16: 139—149. PMID 15863030 DOI:10.1016/j.cytogfr.2005.01.001
Примітки
Див. також
- Хромосома 4
|
 | Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |











