Kyselina asparagová
| Kyselina asparagová | |
|---|---|
 Strukturní vzorec L-asparagové kyseliny | |
 | |
| Obecné | |
| Systematický název | (2S)-2-aminobutandiová kyselina (2S)-2-aminojantarová kyselina |
| Triviální název | Kyselina asparagová |
| Latinský název | acidum asparticum |
| Anglický název | aspartic acid |
| Německý název | Asparaginsäure |
| Funkční vzorec | HOOC-CH2CHNH2-COOH |
| Sumární vzorec | C4H7NO4 |
| Vzhled | Bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 56-84-8 |
| Vlastnosti | |
| Molární hmotnost | 133,10 g/mol |
| Teplota tání | 270–271 °C |
| Hustota | 1,660 g/cm³ (25 °C) |
| Disociační konstanta pKa | 2,19; 3,87 |
| Disociační konstanta pKb | 9,82 |
| Rozpustnost ve vodě | 4 g/l (20 °C) |
| Izoelektrický bod | 3,03 |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Kyselina asparagová (Asp, D) je biogenní aminokyselina vyskytující se v organismu ve formě své konjugované zásady, která se nazývá aspartát. Obsahuje karboxylovou skupinu, je tudíž kyselá, polární a hydrofilní. Kyselina asparagová je součástí bílkovin, během proteosyntézy je kódována triplety GAU a GAC. Kyselina asparagová, přesněji řečeno karboxylová skupina v jejím postranním řetězci, je katalytickou skupinou aspartátových proteáz.
Kromě své úlohy v metabolismu je také substrátem pro mnoho biochemických pochodů – je intermediátem močovinového cyklu a jedním z hlavních substrátů pro syntézu purinových i pyrimidinových bází. U rostlin a mikroorganismů je též prekurzor při syntéze esenciálních aminokyselin methioninu, threoninu, isoleucinu a lysinu. Další významná role kyseliny asparagové je v tzv. malát-aspartátovém člunku, sledu chemických reakcí, při kterých se přenášejí redukční ekvivalenty přes membránu mitochondrií. Z aspartátu též může být fixací dusíku syntetizována aminokyselina asparagin.
Aspartát může fungovat také jako neurotransmiter,[1] společně s glutamátem je hlavní excitační neurotransmiter mozku a míchy.[zdroj?]
Kromě klasické L-formy aspartátu je významná i jeho D-forma, která se vyskytuje v neuronech a žlázách s vnitřní sekrecí, její funkce ale není dobře prozkoumaná.
Historie
Objev kyseliny asparagové začal objevem asparaginu roku 1806 Vauquelinem a Robiquetem. Asparagin byl první objevená aminokyselina a bylo obtížné jej chemicky zařadit. Během analýzy asparaginu izolovaného z proskurníku lékařského zjistil roku 1827 Plisson, že se v rostlinách kromě asparaginu nalézá i jeho kyselina: kyselina asparagová. V proteinech byla kyselina asparagová nalezena Ritthausenem (1869), konkrétně v konglutinu a leguminu z bobů lupiny.[2]
Funkce a vlastnosti
Chemické vlastnosti
Kyselina asparagová je spolu s kyselinou glutamovou, oproti které je o jednu methylenovou skupinu kratší, zástupcem aminokyselin se záporně nabitým postranním řetězcem. Její teoretické pKa je 4, je ve většině případů o něco kyselejší než kyselina glutamová, u obou ale jejich pkA může v proteinech běžně nabývat rozsahu 3,8–4,5. To znamená, že v neutrálním pH buňky má kyselina asparagová záporný náboj. Při některých chemických analýzách, například kyselé hydrolýze, není možné odlišit asparagin a kyselinu asparagovou, při popisu hydrolyzátů se tedy často používá zkratka Asx vyjadřující neurčitost mezi těmito aminokyselinami.[3]
Význam v proteinech
Kyselina asparagová je často využívána ve vazebných místech proteinů nebo aktivních místech enzymů. Díky svému negativnímu náboji může interagovat s pozitivně nabitými atomy, a to včetně kovových kationtů, například se zinkem. V porovnání s jinak podobnou kyselinou glutamovou má kratší řetězec, díky čemuž je v proteinech mnohem rigidnější, a z toho důvodu bývá častěji využíván v aktivních místech enzymů. Příkladem může být jeho funkce v serinových proteázách, ve kterých je součástí katalytické triády Asp–His–Ser. Kyselina asparagová je schopná vytvářet tzv. solný můstek, tedy vodíkový můstek a elektrostatickou interakci najednou.[4]
Malát-aspartátový člunek
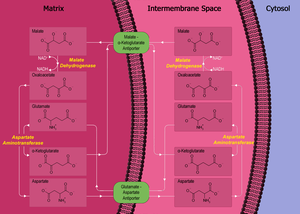
V buněčném dýchání je aspartát využíván v metabolické dráze zvané malát-aspartátový člunek, který umožňuje přenos redukčních ekvivalentů z cytosolu buněk do mitochondrií.[5] Tato dráha umožňuje přenést z cytosolu redukovaný NADH, hromadící se činností glyceraldehyd-3-fosfátdehydrogenázy, do mitochondrií, kde se snadno reoxiduje v dýchacím řetězci. NADH však přes membránu v žádné fázi tohoto cyklu neprochází, přenos je nepřímý.
Neurotransmiter
Aspartát jako konjugovaná báze kyseliny stimuluje NMDA receptory, nicméně role aspartátergní transmise ale v porovnání s glutamátergní dle současných evidencí marginální.. V mozku přítomen ve značném množství. N-acetylaspartát (NAA) je také markerem neuronální viability při magnetické rezonanční spektroskopii, přičemž u řady patologických stavů (Alzheimerova choroba, ischemie aj.) lze idikovat jeho sníženou koncentrace. Po glutamátu druhá nejčetnější molekula v mozku. Aspartát může být vzácně kolokalizován s glutamátem, jinak obšem role aspartátu je primárně jiná než mediátorová. Vvzhledem ke strukturální podobnosti Glu a Asp glutamátové receptory zpravidla aktivovány i Asp nebo jeho deriváty, např.. NMDA N-methyl-D-aspartát).
D-Aspartát
I když se mezi proteinogenními aminokyselinami nevyskytují D-aminokyseliny, některé D-aminokyseliny, jako například D-asparagová kyselina, mohou být v těle používány k jiným účelům, případně mohou být do proteinů připojovány až dodatečně po syntéze, případně se vyskytovat v neribozomálních peptidech, jako je D-aspartát obsahující mikrocystin u sinic. U některých bakterií může být D-aspartát součástí peptidoglykanu namísto běžnějšího D-glutaminu.[6] D-aspartát se vyskytuje v nervových a endokrinních tkáních různých živočichů včetně člověka, kde vzniká především enzymatickou racemizací L-aspartátu, i když pravděpodobně existují i další mechanismy syntézy a buňky dokáží přijímat D-aspartát ze svého okolí. U savců slouží D-aspartát jako klasický neurotransmiter a neuromodulátor (nemusí vyvolávat nervový vzruch), dokáže aktivovat NMDA receptor, ale pravděpodobně pro něj existuje i vlastní receptor, který ovšem doposud nebyl identifikovaný. Funkce D-aspartátu v signalizaci mezi neurony je nejasná, na zvířecích modelech je pozorován vztah mezi učením a hladinou D-aspartátu v mozku a u lidí je snížené množství D-aspartátu spojované s Alzheimerovou chorobou.[7]
Kromě nervových zakončení se D-aspartát vyskytuje ve žlázách s vnitřní sekrecí, jako je šišinka a hypofýza v mozku nebo v nadledvinách a varletech, kde řídí syntézu hormonů, podle zvířecích modelů je důležitý pro tvorbu testosteronu.[8] Z toho důvodu je D-aspartát a jeho deriváty (hlavně N-methyl-D-asparagová kyselina) hojně využíván v kulturistice ve snaze zvýšit množství testosteronu v těle, vědecké studie ale u zdravých, trénujících lidí nepozorují efekt zvýšení výkonu nebo nabírání svalové hmoty a nepozorují signifikantní zvýšení testosteronu.[9][10][11]
Metabolismus
Zdroje
 | Tato část článku je příliš stručná nebo postrádá důležité informace. Pomozte Wikipedii tím, že ji vhodně rozšíříte. |
Kyselina asparagová je neesenciální aminokyselina, proto není nezbytné, aby byla přijímána potravou, pokud má organismus dostatečný přísun jiných aminokyselin.
Biosyntéza a degradace

Kyselina asparagová vzniká v jediném kroku transaminací oxalacetátu. Reakce je zvratná, čehož je využíváno v degradaci asparagové kyseliny. Oxalacetát vstupuje do Krebsova cyklu, nebo může být použit při syntéze glukózy, takže je aspartát považován za glukogenní aminokyselinu.[12]
Biosyntéza kyseliny asparagové z oxalacetátu je zároveň významným mezikrokem pro syntézu dalších molekul, jednak aminokyselin argininu, methioninu, lyzinu, threoninu a z něho vznikajícího izoleucinu, ne všechny z těchto drah jsou ale u lidí funkční. Aspartát také dodává molekulu dusíku při syntéze purinů a uhlíkovou kostru pro syntézu pyrimidinů.[13]
Odkazy
Reference
- ↑ CAVALLERO, A.; MARTE, A.; FEDELE, E. L-aspartate as an amino acid neurotransmitter: mechanisms of the depolarization-induced release from cerebrocortical synaptosomes.. J Neurochem. Aug 2009, roč. 110, čís. 3, s. 924–34. DOI 10.1111/j.1471-4159.2009.06187.x. PMID 19549007.
- ↑ VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169–318.
- ↑ WHITFORD, David. Proteins: Structure and Function. 1.. vyd. [s.l.]: Wiley, 2005. 542 s. Dostupné online. ISBN 978-0471498940. Kapitola 2. Amino acids: the building blocks of proteins, s. 44–45. (anglicky)
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ BELLAIS, S.; ARTHUR, M.; DUBOST, L., et al. Aslfm, the D-aspartate ligase responsible for the addition of D-aspartic acid onto the peptidoglycan precursor of Enterococcus faecium.. J Biol Chem. Apr 2006, roč. 281, čís. 17, s. 11 586 – 11594. DOI 10.1074/jbc.M600114200. PMID 16510449.
- ↑ OTA, N.; SHI, T.; SWEEDLER, JV. D-Aspartate acts as a signaling molecule in nervous and neuroendocrine systems.. Amino Acids. Nov 2012, roč. 43, čís. 5, s. 1873–86. DOI 10.1007/s00726-012-1364-1. PMID 22872108.
- ↑ FURUCHI, T.; HOMMA, H. Free D-aspartate in mammals.. Biol Pharm Bull. Sep 2005, roč. 28, čís. 9, s. 1566–70. PMID 16141517.
- ↑ WILLOUGHBY, DS.; LEUTHOLTZ, B. D-aspartic acid supplementation combined with 28 days of heavy resistance training has no effect on body composition, muscle strength, and serum hormones associated with the hypothalamo-pituitary-gonadal axis in resistance-trained men.. Nutr Res. Oct 2013, roč. 33, čís. 10, s. 803–10. DOI 10.1016/j.nutres.2013.07.010. PMID 24074738.
- ↑ WILLOUGHBY, DS.; SPILLANE, M.; SCHWARZ, N. Heavy Resistance Training and Supplementation With the Alleged Testosterone Booster Nmda has No Effect on Body Composition, Muscle Performance, and Serum Hormones Associated With the Hypothalamo-Pituitary-Gonadal Axis in Resistance-Trained Males.. J Sports Sci Med. Jan 2014, roč. 13, čís. 1, s. 192–9. PMID 24570624.
- ↑ MELVILLE, GW.; SIEGLER, JC.; MARSHALL, PW. Three and six grams supplementation of d-aspartic acid in resistance trained men.. J Int Soc Sports Nutr. 2015, roč. 12, s. 15. DOI 10.1186/s12970-015-0078-7. PMID 25844073.
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 18: Amino Acid Oxidation and the Production of Urea. (anglicky)
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 22: Biosynthesis of amino acids, nucleotides, and related molecules. (anglicky)
Literatura
- MURRAY, Robert K., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 4. vyd. v ČR. Praha: H & H, 2002. ix, 872 s. ISBN 80-7319-013-3
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina asparagová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina asparagová na Wikimedia Commons
| Proteinogenní aminokyseliny | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Obecná témata | |||||||||||||||||||
| Rozdělení |
| ||||||||||||||||||
| Zvláštní případy | |||||||||||||||||||
| Další rozdělení | |||||||||||||||||||
| Skupiny neurotransmiterů | |
|---|---|
| Aminokyseliny, jejich deriváty a peptidy | |
| Endokanabinoidy | |
| Plynné transmitery | |
| Monoaminy | |
| Puriny | |
| Stopové aminy | |
| Ostatní aminy | |







